窒素の化学式とイオン
農業の現場において、窒素肥料の選択は収量と品質を左右する最も重要な要素の一つです。しかし、「窒素成分量」だけを見て施肥設計を行っていないでしょうか。実は、肥料袋に記載された保証成分の裏側にある「化学式」と「イオン形態」こそが、その肥料が土壌と植物に対してどのように振る舞うかを決定づけています。窒素がプラスの電気を帯びた陽イオン(カチオン)であるか、マイナスの電気を帯びた陰イオン(アニオン)であるかによって、土壌への吸着力や植物の吸収メカニズムは根本から異なります。ここでは、化学式レベルで窒素の挙動を解き明かし、より精密な施肥コントロールを実現するための知識を深掘りします。
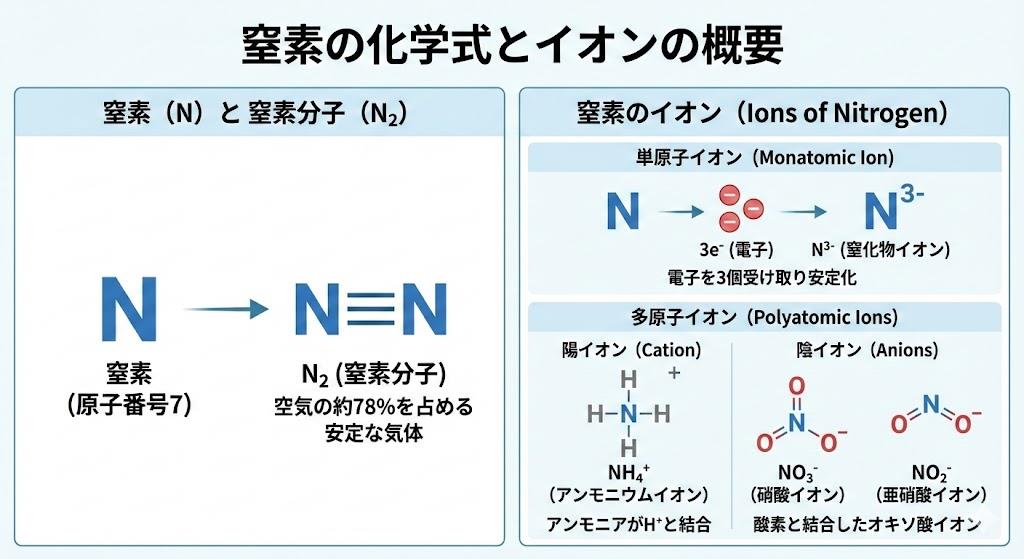
硝酸とアンモニウムのイオン形態の違い
窒素肥料が水に溶けたとき、その窒素は主に二つの異なるイオン形態をとります。一つはアンモニウムイオン(NH₄⁺)、もう一つは硝酸イオン(NO₃⁻)です。この化学式の違いは、単なる記号の違いではなく、電気的な性質の決定的な差を意味します。
- アンモニウムイオン(NH₄⁺):
プラスの電荷を持つ陽イオンです。化学式が示す通り、窒素原子1つに対し水素原子4つが結合しており、比較的安定した形態です。硫安(硫酸アンモニウム)や塩安(塩化アンモニウム)などの肥料は、溶解するとこの形態で窒素を放出します。
- 硝酸イオン(NO₃⁻):
マイナスの電荷を持つ陰イオンです。窒素原子1つに対し酸素原子3つが結合した酸化態です。多くの植物にとって、好気的な畑地土壌における主要な吸収形態となります。
重要なのは、尿素などの有機態窒素も、土壌中での加水分解と硝化作用を経て、最終的にはこれらのイオン形態へと変化するという点です。したがって、施用直後の形態だけでなく、土壌温度や微生物活性によって変化していく「時間軸上の化学式」をイメージすることが、プロの肥培管理には不可欠です。
参考)持続可能な農業を行うために知っておきたい、水や炭素、窒素など…
土壌吸着のメカニズムとイオン電荷
土壌、特に日本の多くの粘土質土壌や腐植を含む土壌は、電気的にマイナス(負)に帯電しています。この「土壌コロイドの負電荷」と「窒素イオンの電荷」の関係性が、肥料の持ち(保肥力)と流亡しやすさを決定します。
- NH₄⁺(陽イオン)の挙動:
プラスの電荷を持つアンモニウムイオンは、マイナスに帯電した土壌粒子に電気的に引き寄せられ、強く吸着されます(CEC:塩基置換容量)。そのため、灌水や降雨があっても流亡しにくく、土壌に留まりやすいという特性があります。これが、基肥としてアンモニア態窒素が好まれる化学的な理由です。
- NO₃⁻(陰イオン)の挙動:
マイナスの電荷を持つ硝酸イオンは、同じくマイナスの土壌粒子と反発し合います。そのため土壌に吸着されず、土壌水(土壌溶液)の中に浮遊した状態で存在します。これは植物にとって極めて吸収しやすい状態である反面、雨が降れば水とともに容易に地下深くへ溶脱してしまうリスクを孕んでいます。
参考)https://www.agrinet.pref.tochigi.lg.jp/nousi/kenpou/kp_045/45_01.pdf
この吸着メカニズムの違いを理解すれば、「なぜ追肥には速効性の硝酸系が効くのか」「なぜ砂質土壌では分施が必要なのか」が、化学的な裏付けを持って理解できるようになります。
吸収効率とエネルギー代謝の意外な真実
植物が根から窒素を吸収した後、体内でタンパク質を合成する過程において、イオン形態の違いは植物の「エネルギーコスト」に大きな影響を与えます。実は、植物にとって硝酸イオンの利用は、アンモニウムイオンに比べて代謝エネルギーを多く消費するプロセスなのです。
- 硝酸還元のコスト:
植物が吸収した硝酸イオン(NO₃⁻)は、そのままではアミノ酸の材料になれません。体内で一度アンモニウム(NH₄⁺)の状態まで「還元」する必要があります。この化学反応(NO₃⁻ → NO₂⁻ → NH₄⁺)には、ATP(エネルギー通貨)や還元力が必要となります。
参考)植物とアミノ酸のふしぎな関係
- アンモニウムの即戦力性:
一方、アンモニウムイオンとして吸収された窒素は、還元の手間が省けるため、エネルギー的には効率よくアミノ酸合成(グルタミン合成)へ回すことができます。
- なぜ硝酸を吸うのか?:
エネルギー効率だけを見ればアンモニウムが有利に見えますが、高濃度のアンモニウムは植物細胞にとって毒性が強く(アンモニア毒性)、多くの植物は安全な貯蔵形態である硝酸イオンとして吸収することを好みます(好硝酸性植物)。
このエネルギー収支の視点は、日照不足や低温時など、植物の光合成エネルギーが低下している局面での施肥判断において、非常に示唆に富む情報となります。
拮抗作用が生むカルシウム欠乏の正体
「窒素は効いているのに、なぜかカルシウム欠乏(チップバーンや尻腐れ)が出る」。この現象の背後には、イオン同士の壮絶な椅子取りゲーム、すなわち「拮抗作用(アンタゴニズム)」が隠れています。
植物の根は、土壌溶液中のイオンバランスに敏感です。特に陽イオン(カチオン)同士は、根の吸収サイトを取り合うライバル関係にあります。
- NH₄⁺ vs Ca²⁺・Mg²⁺・K⁺:
アンモニウムイオン(NH₄⁺)が土壌中に過剰に存在すると、同じ陽イオンであるカルシウム(Ca²⁺)、マグネシウム(Mg²⁺)、カリウム(K⁺)の吸収を強力に阻害します。特にカルシウムは植物体内での移動性が低いため、吸収阻害の影響が新芽や果実の先端に顕著に現れます。トマトの尻腐れ症が、窒素過多(特にアンモニア態窒素の過剰)で助長されるのはこのためです。
- NO₃⁻の相乗効果:
逆に、陰イオンである硝酸イオン(NO₃⁻)を吸収する際、植物は電気的な中性を保つために、陽イオン(Ca²⁺やK⁺)を道連れにして吸収しようとする働き(相乗作用)があります。
カルシウム剤を葉面散布しても治らない欠乏症が、実は「窒素形態の変更(アンモニア態から硝酸態への切り替え)」であっさり解決する場合があるのは、このイオン拮抗のメカニズムによるものです。
対イオンが左右する肥効と土壌環境
最後に、窒素肥料の化学式において見落とされがちな「対イオン(カウンターイオン)」について触れておきましょう。硫安なら「硫酸イオン(SO₄²⁻)」、塩安なら「塩化物イオン(Cl⁻)」が、窒素(アンモニウム)のパートナーとして含まれています。これらは単なる運び屋ではなく、土壌環境に独自のインパクトを与えます。
- 硫酸根(SO₄²⁻)の影響:
硫安などの硫酸根を持つ肥料は、生理的酸性肥料として知られ、土壌pHを低下させる力が強いです。また、水田のような嫌気条件下では、硫酸イオンが還元されて有害な硫化水素(H₂S)ガスを発生させ、根腐れ(秋落ち)の原因となることがあります。一方で、アブラナ科野菜など硫黄を好む作物には食味向上効果が期待できます。
- 塩化物根(Cl⁻)の影響:
塩安に含まれる塩素は、過剰になると塩類障害を引き起こす可能性がありますが、繊維質を強化する働きがあり、麻やイグサなどの繊維作物では品質向上に寄与します。しかし、施設栽培などの雨による洗浄が期待できない環境では、対イオンとしての塩素や硫酸基が土壌に残存し、EC(電気伝導度)を異常に高める「見えない主犯」になることがあります。
「窒素何キロ」という計算だけでなく、その窒素が「誰と手を繋いでいるか(化学式)」まで見ることで、土壌の健康状態や作物の品質を一歩先のレベルで管理することが可能になります。

SMART SENSOR(スマートセンサー)多機能水質検出器 AR8407|ポータブル 溶存酸素 pH/PH値 亜硝酸塩 アンモニア態窒素 測定液体 産業 研究所 農業 医療 育種 科学研究 環境保護




